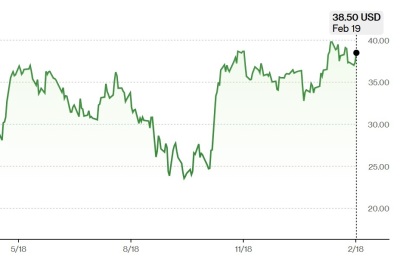
[서울=뉴스핌] 이영기 기자 = 나이벡은 호주 '인체연구윤리위원회(HREC)'로부터 염증성장질환 치료제에 대한 임상 1b/2a상 시험계획(IND)을 승인받았다고 12일 밝혔다. 이번 임상승인으로 세계 최초 재생 기전 펩타이드를 기반으로 한 나이벡의 염증성장질환 치료제에 대한 글로벌 임상 2상이 본격화될 전망이다.
이번 글로벌 임상 1b/2a상은 피하주사 제형으로 총 78명에게 투약된다. 1b상에서는 24명의 건강한성인을 대상으로 증량 반복투여를 실시해 안전성과 약동학 평가 등을 실시한다. 2a상에서는 경증 및 중증 궤양성 대장염 환자 54명에게 피하주사로 증량 반복 투여를 통해 안전성과 내약성, 약동학 분석 등을 평가한다.
앞서 나이벡은 동일한 약물에 대해 폐섬유증 치료제로 글로벌 임상1상을 성공적으로 마치며 인체 안전성을 입증한바 있다. 해당 글로벌 임상1상에서 중대한 이상반응이 나타나지 않았으며, 고농도에서도 흡수, 분포, 배설에 이르기까지 정상으로 나타났다. 약물의 반감기 또한 적정 시간 유지되는 것으로 확인됐기 때문에 이번 염증성장질환 치료제 글로벌 임상도 좋은 결과가 예상된다는 게 회사 측 설명이다.
나이벡 관계자는 "이번 염증성장질환 치료제 글로벌 임상은 약 4개월 정도 소요되며 내년 상반기 중에는 임상결과가 나올 것으로 예상된다"며 "글로벌 임상과 동시에 미국 식품의약국(FDA) 임상 2a 상도 준비 중으로 임상 2상 결과를 최대한 앞당기겠다"고 말했다.
그는 이어 "기존 염증성장질환 치료제는 항염증제 및 면역억제제 중심으로 염증을 억제해 증상을 완화하는 데 초점이 맞춰져 있다"며 "나이벡이 개발 중인 치료제는 손상된 조직세포의 재생을 촉진하는 펩타이드 기반 치료제로, 근본적인 치료가 가능하기 때문에 많은 글로벌 제약사들이 주목하고 있다"고 강조했다.
글로벌 시장조사기관 'The Insight Partners'에 따르면 올해 글로벌 염증성 장질환 치료제 시장규모는약 240억 5000만달러(33조 6002억원)로 추정된다. 해당 시장은 연평균 성장률 3.5%를 기록해 2031년에는 약 316억 7000만달러(44조 2334억원)에 달할 것으로 예상된다.
 |
007@newspim.com