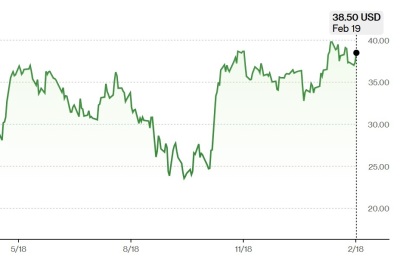
내년 인공혈액 'SBX' 전임상 결과 발표 예상
이 기사는 12월 14일 오전 09시18분 AI가 분석하는 투자서비스 '뉴스핌 라씨로'에 먼저 출고됐습니다.
[서울=뉴스핌] 이나영 기자= 바이오의약품업체 선바이오가 미국식품의약국(FDA) 승인을 받은 구강건조증 치료제 '뮤코펙'에 대한 해외 기술이전을 추진 중이다. 아울러 페길레이션 기술을 접목한 치료제 수요에 대비해 제2신공장 증성을 진행 중이다.
선바이오 관계자는 14일 "공장은 7월쯤 완공 예정이며 본격적인 생산은 2025년으로 보고 있다. 생산능력은 약 10배정도 늘어난다"며 "FDA 승인을 받은 구강건조증 치료제 '뮤코펙'은 현재 해외 라이선싱(기술이전)을 위해 계속 추진 중에 있다. 미코팩과 호중구 감소증 치료제 '뉴페그'에 대한 매출 증가에 대비해 생산능력을 확대하려는 계획이다"고 말했다.

선바이오는 생체적합 고분자(PEG)에 반응기를 더한 PEG 유도체를 목표물질에 결합해 혈중 반감기를 늘리는 페길레이션(PEGylation) 기술을 보유한 업체다. 바이오시밀러, 바이오 신약, 의료기기 등 다양한 분야에 페길레이션 기술을 접목해 상품화하는 사업 모델을 가지고 있다.
대표 품목으로는 지난 2003년 다국적 제약사 인타스(Intas Pharma)에 기술이전한 호중구감소증 치료제 뉴라스타(Neulasta) 바이오시밀러 '뉴페그'(Neupeg)와 구강건조증 치료제 '무코펙'(MucoPEG)이 있다.
뮤코펙은 항암치료 및 당뇨, 항고혈압 등 다양한 약물복용과 두경부 방사선 조사에 의한 타액선 손상 등의 원인으로 구강건조증 질환을 나타내는 환자들을 치료하는 목적의 치료제다. 지난 2019년 11월 FDA으로부터 판매허가를 획득했고, 2020년에는 중국 파마솔루션사에 기술이전 및 중국 내 판권을 이전했다.
현재 뉴페그는 FDA 품목허가 승인을 진행하고 있다. 하나증권에 따르면 지난 3월 제조시설 실사 결과에 대한 보완 서류를 제출해 오는 2024년 미국 승인 및 출시가 이뤄질 것으로 예상한다. 뉴페그가 미국 승인을 받으면 해당 분야의 페그 유도체 생산량은 2~3배 증대될 것으로 전망하고 있다.
선바이오 관계자는 "미국은 유럽에 비해 약값이 매우 비싼 편에 속한다. 뉴페그 승인시, 미국에서 상당한 매출이 일어날 것으로 예상하고 있다"고 말했다.
올해는 바이오 기술을 활용한 2차전지 사업에도 나섰다. 선바이오는 지난 4월 2차전지 및 연료전지 전고체 전해질 기술개발과 기술이전, 관련 소재 생산 및 판매 사업 진출을 의결하며 사업을 확장한 바 있다. 지난 7월에는 2차전지 관련 특허 2건을 인수했다.
이외에도 선바이오는 페길레이션 기술을 기반으로 인공혈액 'SBX'와 연골활액 충진제 '시노젤', 통풍치료제 'xPEG-유리케이스'를 개발해 미래 성장동력을 확보할 계획이다.
선바이오 관계자는 "2차전지는 2025년 개발을 목표로 삼으며 페길레이션 기술을 전해질 개발에 접목해 연구에 집중하고 있다. 인공혈액은 전임상 동물 실험 업무를 현재 미국에서 하고 있다. 전임상 결과는 내년 여름쯤이면 나올 것으로 예상하고 있다"고 말했다.
nylee54@newspim.com