헬릭스미스, 내년 상반기 엔젠시스 미국 임상 3상 종료 예정
신라젠, '펙사벡' 중국 임상 진행중
[서울=뉴스핌] 박다영 기자 = 글로벌 임상 3상에서 고배를 마셨던 국내 바이오 업체들이 재도전에 나선다. 특히 허가 과정에서 성분을 제대로 기재하지 않거나, 임상시험 관리상 문제가 있었던 것으로 드러나 문제가 있었던 업체의 경우 앞으로 진행할 새로운 임상도 잘 따져봐야 한다는 목소리가 나온다.
6일 관련업계에 따르면 코오롱티슈진은 연내 미국에서 골관절염 유전자 치료제 '인보사케이주(이하 인보사)'의 임상 3상을 다시 들어간다. 올 4분기에 환자 투약을 재개하는 것이 목표다.

앞서 인보사는 2019년 3월 미국 식품의약국(FDA)으로부터 임상 3상을 승인받고 진행하던 중 주성분 중 하나가 허가를 받을 당시 기재했던 것과 다른 것으로 드러났다. 이에 따라 우리 식품의약품안전처는 인보사의 품목허가를 취소했고, FDA도 임상 3상을 잠정 중단했다. 이후 지난해 4월 FDA로부터 미국 임상 3상 재개를 승인받았다.
이번 인보사의 재도전은 FDA로부터 임상 재개를 승인받은 후 1년만에 환자 투약을 들어갈 시점에 대해 가닥을 잡은 것이다. 이에 따라 임상시험을 실시할 각 병원에서 심의를 거친 후 환자 등록을 시작하고 이후 모집된 환자들은 투약을 받게 된다.
코오롱생명과학 관계자는 "올 4분기 미국에서 인보사 임상 3상 환자 투여를 재개하는 것이 목표"라며 "관련 사항은 각 임상 기관에서 진행하게 될 예정"이라고 말했다.
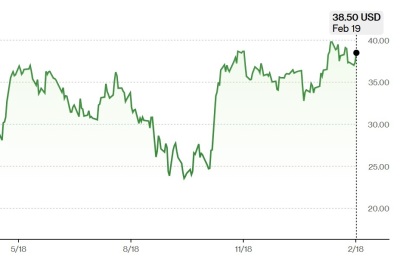
헬릭스미스는 당뇨병성 신경병증 치료제 '엔젠시스(VM202)'의 임상 3-2상을 진행중이다. 이 임상은 지난 2019년 실패한 임상 3상을 보완한 것으로, 내년 상반기 내 종료하는 것이 목표다.
앞서 헬릭스미스는 2019년 임상 3상 진행 도중 엔젠시스 투약군 중 일부는 위약(가짜약)을, 위약군의 일부는 엔젠시스를 투약받으면서 약물 혼용이 일어나 임상에 실패했다. 하지만, 데이터 분석 결과 약물 혼용은 없었고 유효성을 입증하지 못한 것이라는 게 이 회사의 설명했다.
김선영 헬릭스미스 대표는 지난달 주주총회에서 "2022년 10월 31일까지 목표를 달성하지 못하면 보유하고 있는 헬릭스미스 주식 전부를 출연하겠다"고 했다. 김 대표가 내건 목표는 엔젠시스의 임상 3상 성공과 주가를 10만원까지 끌어올리는 것 두 가지다. 임상 3-2상이 성공할 것이라고 자신한 셈이다.
신라젠도 지난해 항암 바이러스 치료 후보물질 '펙사벡'의 중국 임상 1·2상에 들어갔다. 펙사벡은 2019년 글로벌 임상 3상에 실패했던 바 있다. 중국에서는 현지 파트너사인 리스팜 주도로 흑색종 환자 대상 임상을 진행중이다.
글로벌 임상 3상에서 고배를 마셨던 바이오 업체들이 재기에 나섰지만, 업계 안팎에서 바라보는 시선은 냉랭하다.
업계 한 관계자는 "단순한 임상 실패가 아니라 허가나 임상 데이터 관련한 이슈가 있었던 업체들의 임상 재개는 신중히 살펴봐야 한다"고 말했다. 또 다른 업계 관계자는 "부정적 이슈로 국내 바이오 업계 전반의 신뢰도를 떨어뜨렸던 기업들은 새로 들어가는 임상은 데이터로 결과를 증명해야 할 것"이라고 했다.
allzero@newspim.com