RP1의 병용요법 승인 판단 거부
임상시험의 부적절성 문제 제기
당초엔 승인 기대, 우선순위 지정 등
이 기사는 7월 25일 오후 3시33분 '해외 주식 투자의 도우미' GAM(Global Asset Management)에 출고된 프리미엄 기사입니다. GAM에서 회원 가입을 하면 9000여 해외 종목의 프리미엄 기사를 보실 수 있습니다.
[서울=뉴스핌] 이홍규 기자 = 최근 미국 의약당국으로부터 치료제 사용 승인 판단에 대한 거부 통보를 받아 주가가 폭락한 의약품 개발회사 레플리뮨(종목코드: REPL) 주식을 우리나라 투자자들이 집중적으로 사들이고 나섰다.
◆하루 낙폭 77%
한국예탁결제원에 따르면 24일까지 18일부터 한 주 동안 레플리뮨 주식 순매수액은 약 594만4000달러(약 81억6500만원)를 기록했다. 상장지수펀드(ETF) 등 주간 미국 주식 순매수액 상위 50위(44위)에 포함됐다.
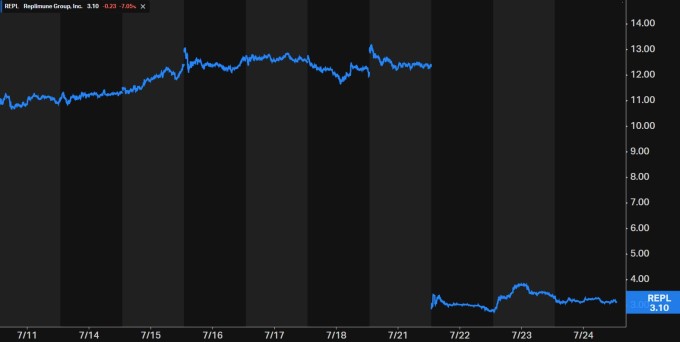
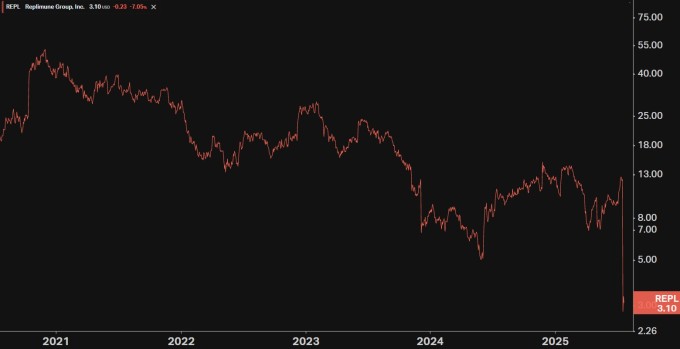
투자자들이 레플리뮨의 주식을 사들인 배경에는 최근 주가 낙폭이 상당하다는 점에 있다. 레플리뮨 주가는 이번 주 22일 하루에만 낙폭이 77%을 기록했는데 종전까지 2주 동안 승인 기대감으로 30% 넘게 올랐던 것에 비교하면 대반전이라고 할 수 있다.
◆FDA 거부 통보
레플리뮨 주가가 폭락한 것은 당일 미국 식품의약국(FDA)이 회사의 치료 후보물질 사용에 대해 승인 거의 막판 단계에서 '판단 거부' 통보를 내렸기 때문이다. 투자자 사이에서는 종전 절차에서 유리한 단계를 밟아 최종 승인 기대감이 컸던 만큼 '예기치 않은' 충격으로 다가왔다.
FDA의 판단 거부 대상은 RP1과 니볼루맙의 병용요법이다. 구체적으로는 'RP1이라는 물질을 니볼루맙과 함께 사용하는 것'에 대해 판단 거부를 내린 것이다.

거부 사유는 임상시험의 부적절성이다. 환자군 선정 등 임상시험 설계와 에서 문제가 있다는 취지다. 임상시험에서 비교군 없이 단일군으로 진행한 부분에 문제가 있어 보이고 병용요법용 임상시험 설계 자체가 단독요법과 병용요법을 모두 포함하고 있어 어떤 게 효능 기여도가 높은지 정확히 구분히 안 된다는 뜻을 밝혔다.
FDA는 "효과성의 실질적 증거를 제공했다거나 적절하게 잘 통제된 임상연구로 간주되지 않는다"고 했다.
◆어떤 물질
RP1은 레플리뮨이 개발해 온 종양용해용 바이러스 치료 후보물질이고 니볼루맙은 브리스톨-마이어스스큅의 치료제다. 피부암인 흑색종을 비롯해 이미 여러 암종 치료제로 활용되고 있다.
병용요법 추진 목적은 흑색종 치료에서의 효과 극대화다. RP1 역시 흑색종에서도 단독요법으로 개발돼 왔지만 니볼루맙과 병용했을 때의 효과가 크다고 판단했다. 효과가 큰 만큼 급성장하는 흑색종 치료제 시장에서 높은 판매액 달성이 가능하다고 봤다.
그랜드뷰리서치에 따르면 세계 흑색종 치료제 시장의 규모는 2022년 50억8000만달러로 추산됐고 2023년 대비로 보면 2030년까지 연평균 10.3% 늘어나 109억8000만달러가 될 것으로 전망됐다. 앞서 JP모간은 미국에서의 RP1 최고 매출액을 약 7억달러로 전망했다.
◆"대실소망"
투자자 사이에서는 워낙 기대가 컸던 터라 충격 또한 상당했다. FDA의 신약 승인 과정을 ①임상시험 ②시판허가 신청 ③심사과정 ④승인 결정으로 압축했을 때 병용요법은 ②단계에서 획기적치료법 지정과 우선심사 지위를 부여받는 등 특별 승인 경로를 받아 최종 승인이 유력하게 점쳐졌다.
*획기적치료법 지정(Breakthrough Therapy designation)은 FDA가 심각하거나 생명을 위협하는 질환을 대상으로 기존 치료법 대비 상당한 개선 가능성을 보인 약물에 부여하는 개발 촉진 제도다.
▶②편에서 계속
bernard0202@newspim.com