[서울=뉴스핌] 이나영 기자= 퓨쳐메디신이 22일 자사가 개발 중인 비알코올성지방간염(NASH) 치료 혁신신약 FM101에 대해 DSMB(데이터안전성모니터링위원회)가 글로벌 임상2상을 변경 없이 계속 진행할 것으로 권고했다고 밝혔다.
DSMB는 각국 규제기관이 승인한 임상시험계획서(프로토콜) 상의 공식 위원회로서, 임상시험의 중간 시점에 안전성과 유효성을 평가해 임상의 속행 여부를 결정∙권고하는 기관이며, IDMC(독립적 데이터모니터링위원회)와 같은 역할을 하는 기관이다.
퓨쳐메디신 관계자는 "이번 FM101 임상시험의 DSMB는 독립된 외부 전문가 5명(간질환 전문의 4명, 바이오 통계학자 1명)으로 구성됐으며, 목표 대상자 중 50%가 투약 완료된 시점에 이중맹검이 해제된 데이터를 직접 검토해 FM101의 임상 속행 권고 의견을 전달해왔다"면서 "안전성뿐만 아니라 유효성을 평가해 내린 계속 진행 권고라는 점에서 의미가 크다"고 설명했다.

DSMB의 공식 권고 의견은 ▲수정 없이 계속 진행 ▲시험계획 수정 후 계속 진행 ▲추가 데이터 확보를 위한 일시 중단 ▲중지 등 4가지 유형이 있다. 임상시험계획서에 기재된 내용에 따르면, 퓨쳐메디신에 전해진 '수정 없이 계속 진행' 권고 의견의 경우 유효성 결과가 'promising'일 때 권고하는 의견이다.
NASH 치료제 FDA 가이드라인에 따르면, 신약 승인 조건으로 후기임상 시험에서 함염증, 함섬유화 효과를 조직검사를 통해 증명해야 하며, 환자 대상 초기 임상에 대해서는 개념증명(PoC) 단계로서 바이오마커를 확인하는 단계이다.
퓨쳐메디신 임상 담당자는 "본 임상시험을 통해 직접적인 바이오마커인 TNF-α, Interleukin-6 등 염증성 사이토카인 수치가 감소하고, 간 경직도를 측정해 섬유화 정도를 확인할 수 있는 MRI-MRE 수치도 감소하는 것으로 임상 데이터를 해석하고 있고, 이는 최종임상시험보고서(CSR)로 확인할 수 있을 것으로 보인다"면서 "비임상에서 항염증, 항섬유화에 탁월한 효과를 보인 만큼 인체 대상의 임상시험에서도 동일한 효과를 보일 것으로 기대한다"고 강조했다.
NASH 치료제는 올해 3월 세계 최초로 미국의 마드리갈파마슈티컬社의 레즈디프라(성분명: 레스메티롬)가 FDA 허가를 받아 출시된 이후 세계적으로 더욱 활발히 개발되고 있다. 다양한 기전으로 발생하는 비알콜성지방간염의 특성과 현재 미충족된 의료수요를 감안할 때 향후 높은 의료수요를 보일 것으로 예상되며, 이를 증명하듯 NASH 치료제 개발사들은 높은 시가총액을 기록하고 있다.
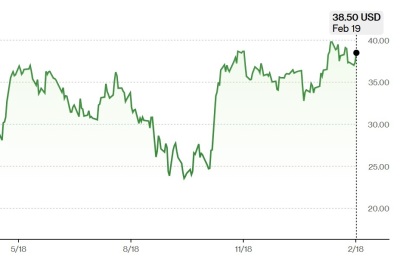
지난 18일 기준, 매드리갈파마슈티컬스 시가총액은 약 46.61억달러, 바이킹테라퓨틱스와 89바이오는 각각 약 71.28억달러, 약 8.3억달러이다.
한편, 퓨쳐메디신은 자사의 또 다른 파이프라인인 비만치료제(FM801)에 대해서도 비임상 유효성을 확인하면서 글로벌 제약사들과 기술이전 논의를 위한 CDA(비밀유지계약)를 체결하는 등 사업화에 속도를 내고 있다.
또한 퓨쳐메디신은 오는 6월 세계 최대 바이오 행사인 BIO USA 2024에서 Company Presentation 기업으로 선정돼 NASH(MASH)치료제와 비만치료제의 효능을 주제로 발표할 예정이며, 이를 통해 기술이전에 박차를 가한다는 전략이다.
nylee54@newspim.com