중성지방 73% 감소, 급성 췌장염 85% 예방
월가, 블록버스터 약물로 성장 가능성 주목
이 기사는 9월 10일 오후 4시54분 '해외 주식 투자의 도우미' GAM(Global Asset Management)에 출고된 프리미엄 기사입니다. GAM에서 회원 가입을 하면 9000여 해외 종목의 프리미엄 기사를 보실 수 있습니다.
[서울=뉴스핌] 김현영 기자 = 미국 RNA 표적 치료제 전문 기업 아이오니스 파마슈티컬스(종목코드: IONS)가 연일 강세 행진을 이어가며 투자자들의 이목을 집중시키고 있다. 9일(현지시간) 뉴욕증시에서 아이오니스 주가는 전일 대비 5.57% 상승한 64.40달러로 거래를 마쳤고, 장중에는 64.71달러까지 올라 또다시 52주 최고가를 갈아치웠다. 이로써 시가총액은 102억 6000만 달러로 확대됐다.
주목할 점은 이번 주가 상승이 일시적 현상이 아니라는 점이다. 올해 들어 아이오니스 주가는 84.21% 뛰었으며, 최근 1년간으로는 51.92% 상승했다. 9일 주가는 2019년 4월 이후 최고 수준으로 올랐고, 이는 회사가 본격적인 성장 궤도에 진입했음을 시사한다.

◆ 트린골자 임상 성공이 견인한 주가 상승
최근 아이오니스 주가 급등의 직접적 계기는 지난 2일 발표된 트린골자(Tryngolza, 성분명 올레자르센)의 임상 3상 시험 결과다. 중증 고중성지방혈증(sHTG) 치료를 위한 이 연구는 그야말로 '완벽한 성공'을 거뒀다. 총 1063명의 환자가 참여한 CORE 및 CORE2 연구에서 1차와 2차 평가변수를 모두 충족하며 최상의 시나리오를 현실화했기 때문이다.

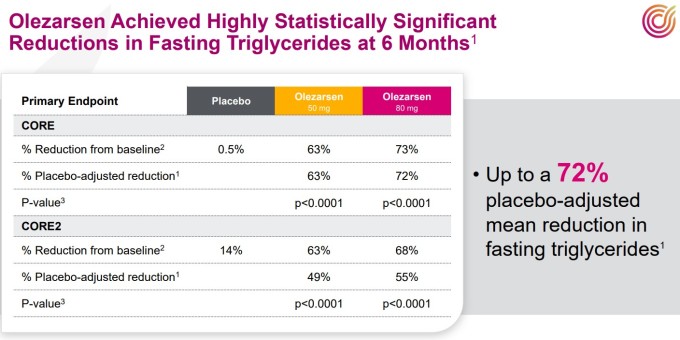
핵심 성과는 중성지방(TG) 감소 효과다. 중성지방은 혈중 지방의 일종으로, 수치가 높을 경우 심장 질환과 췌장염 위험을 증가시킨다. CORE 연구에서 6개월 시점에 올레자르센 80mg 투여군은 기준선 대비 공복 중성지방 수치를 73% 감소시켰다.
위약군의 0.5% 감소와 비교하면 실질적으로 72%의 위약 대비 감소 효과를 입증한 셈이다. 50mg 투여군도 63%의 뛰어난 효과를 보였다. CORE2에서 기준선 대비 공복 중성지방 수치 감소율은 80mg 투여군이 68%, 50mg 투여군이 63%였고, 위약군은 14%로 위약 대비 감소율은 각각 55%, 49%였다.
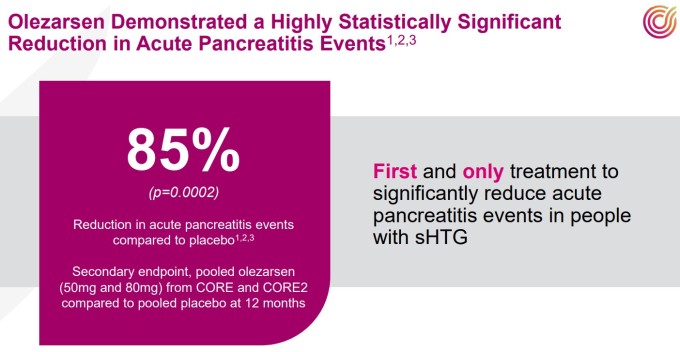
더욱 놀라운 것은 2차 평가변수인 급성 췌장염(AP) 예방 효과다. 12개월 동안 두 연구의 통합 분석 결과 올레자르센은 위약 대비 85%의 급성 췌장염 발생 감소 효과를 나타냈다. 이는 애널리스트들이 예상했던 최소 기준인 20~30%를 훨씬 상회하는 수치로, 의학계에 중대한 의미를 던진다.
◆ 급성 췌장염 예방 효과까지
급성 췌장염은 중증 고중성지방혈증(sHTG) 환자들이 직면하는 가장 치명적인 합병증 중 하나다. 예측 불가능하고 생명을 위협하는 이 질환에 대해서는 지금까지 마땅한 예방 치료제가 존재하지 않았다. 올레자르센이 급성 췌장염 발생을 유의미하게 감소시킨 최초의 sHTG 치료제가 될 수 있다는 점에서 의학사적 의의가 크다.
아이오니스의 샘 치미카스 글로벌 심혈관 개발 부문 수석부사장은 "이 데이터는 획기적이며, 올레자르센이 sHTG 치료 패러다임을 바꿀 잠재력을 지녔음을 입증한다"고 강조했다. 실제로 sHTG 분야에서 이 정도의 임상적 효과를 보인 사례는 극히 드물어, 의료진들 사이에서도 큰 화제가 되고 있다.
올레자르센은 체내 아포지질단백질 C-III(apoC-III) 생산을 감소시키도록 설계된 RNA 표적 의약품이다. 간에서 생성되어 혈중 중성지방 대사를 조절하는 핵심 단백질인 아포지질단백질 C-III를 억제함으로써 중성지방 수치를 효과적으로 낮추는 메커니즘을 갖고 있다.
◆ 안전성 프로필 확보로 상용화 가능성 높여
임상적 효과만큼 중요한 것이 안전성이다. 트린골자의 임상시험에서는 양호한 안전성 및 내약성 프로필이 확인됐다. 이상반응은 치료군 간에 전반적으로 유사했으며, 오히려 중대한 이상반응은 위약군보다 올레자르센 투여군에서 더 적게 발생했다. 가장 흔한 이상반응은 주사부위반응으로 대부분 경미한 수준이었다.
이러한 안전성 데이터는 규제 당국의 승인 과정에서 매우 중요한 요소다. 특히 장기간 투여가 필요한 만성 질환 치료제의 경우 안전성이 더욱 중요한 평가 기준이 된다. 트린골자가 보여준 우수한 안전성 프로필은 향후 승인 과정에서 긍정적으로 작용할 것으로 예상된다.
◆ 월가 애널리스트들 일제히 긍정 평가
이 소식에 월가는 즉각 반응했다. 아이오니스 주가는 임상 결과 발표 당일인 2일 거래에서 34.8% 급등한 57.49달러로 마감하며 2021년 2월 이후 최고치를 기록했다. 이후에도 상승세는 지속되어 9일에는 64달러를 돌파했다.
애널리스트들의 평가는 한결같이 긍정적이다. RBC 캐피털 마켓의 루카 이시 애널리스트는 "이는 아이오니스에게 절대적으로 최선의 시나리오이며 홈런급 결과"라고 평가했다. 이시는 "중성지방 감소는 어느 정도 예상되었지만, 대부분 투자자들은 급성 췌장염의 통계적 유의미한 감소는 동전 던지기 수준으로 생각했다"며 "85%라는 놀라운 감소 효과는 완전히 예상을 뛰어넘는 결과"라고 설명했다.

윌리엄 블레어의 마일스 민터 애널리스트 역시 "이 데이터는 아이오니스에게 최상의 시나리오이며, 우리 기대치를 크게 뛰어넘는 결과"라고 평가했다.
H.C. 웨인라이트는 목표주가를 70달러에서 95달러로 상향 조정하는 한편 올레자르센 승인 가능성을 75%에서 85%로 높이고 최고 침투율 추정치를 7.5%에서 10%로 높여 글로벌 올레자르센 수익이 이전 추정치인 32억 달러에서 42억 달러에 이를 것으로 전망했다.
RBC 캐피털은 70달러에서 80달러로, 오펜하이머는 78달러에서 81달러로 각각 목표주가를 인상했다. BMO 캐피털은 아예 투자의견을 '시장 수익률'에서 '시장수익률 상회'로 업그레이드하며 블록버스터 잠재력을 인정했다.
BMO 캐피털은 올레자르센이 미국 시장에서 블록버스터 약물이 될 수 있다고 보고, 2026년에 발표될 Lp 및 ATTR-CM에 대한 주요 데이터가 추가적인 촉매제가 되어 회사의 주가 상승을 이끌 수 있다고 말했다. 여기에 더해 엔젤만 증후군 치료제가 아이오니스의 가치 제안을 더욱 강화할 수 있는 수십억 달러 규모의 잠재적 기회라고 강조했다.
월가 애널리스트들의 투자의견을 종합하면 '매수' 의견이 우세하다. CNBC 집계에 따르면, 26개 투자은행(IB) 중 9곳이 '강력 매수', 10곳이 '매수', 6곳이 '보유' 의견을 제시했다. '시장수익률 하회' 의견도 1곳 있었다. 이들이 제시한 목표주가 평균은 69.61달러로, 현재 주가에서 8.09%의 추가 상승 여력을 나타낸다. 월가에서 제시한 최고 목표주가는 96달러, 최저 목표주가는 43달러이다.
◆ 엔젤만 증후군 치료제, 또 다른 성장 동력으로 부상
트린골자의 임상 성공에 더해 9일 발표된 또 다른 호재가 주가 상승을 가속화했다. 아이오니스의 실험 약물 ION582가 미국 식품의약국(FDA)으로부터 엔젤만 증후군 치료제로 혁신 치료제(Breakthrough Therapy) 지정을 받았다는 소식이다.
엔젤만 증후군은 전 세계적으로 약 2만1000명 중 1명꼴로 발생하는 희귀 신경질환이다. 모계 UBE3A 유전자의 기능 상실로 인해 발생하며, 일반적으로 유아기에 나타난다. 심각한 지적 장애, 운동 장애, 균형 문제, 쇠약성 발작이 특징이며, 대부분의 환자는 말을 할 수 없고 평생 간병인의 지원이 필요하다. 현재까지 승인된 질병 수정 치료법이 전혀 없는 상황이다.
이번 혁신 치료제 지정은 ION582의 1/2상 HALOS 연구 결과를 바탕으로 이루어졌다. 아이오니스는 이 연구에서 의사소통, 인지 및 운동 기능을 포함한 모든 엔젤만 증후군 기능 영역에서 "일관되고 고무적인 임상 개선"이 나타났다고 발표했다. 또한 양호한 안전성과 내약성도 확인됐다.
ION582는 UBE3A 안티센스 전사체의 발현을 억제하고 UBE3A 단백질 생산을 증가시키도록 설계된 RNA 표적 안티센스 의약품이다. FDA는 이전에 이 약물에 희귀의약품 지정, 신속 심사 지정, 희귀 소아질환 지정을 부여했으며, 유럽의약품청(EMA)도 희귀의약품 지정을 부여했다.
아이오니스의 신경학 담당 수석 부사장인 홀리 코르다시에비츠는 "엔젤만 증후군을 앓고 있는 사람들을 위해 승인된 질병 수정 치료법이 없는 상황에서 ION582에 대한 이번 혁신 치료제 지정은 이 질병의 심각성과 치료에 대한 중요한 미충족 요구를 강조한다"고 의미를 부여했다.
현재 아이오니스는 ION582의 글로벌 3상 REVEAL 연구를 진행 중이다. 이 연구에는 모계 UBE3A 유전자 결실이나 돌연변이가 있는 엔젤만 증후군 아동 및 성인이 등록될 예정이며, 회사는 2026년까지 등록을 완료할 것으로 예상한다고 밝혔다.
▶②편에서 계속됨