[뉴스핌=한태희 기자] 국내 제약사들이 신약 '가뭄'에 허덕이고 있다. 한미약품의 신약 기술 수출 소식과 국내 개발신약 증가 등 지난해 국내외에서 놀랄 만한 성과를 냈지만 1년도 안 지나 상황이 180도 변했다.
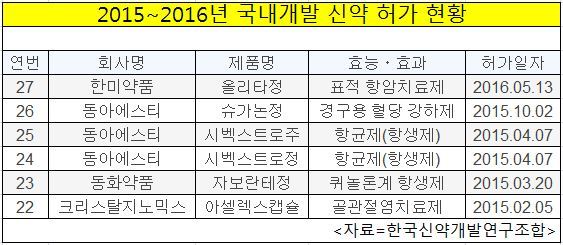
13일 한국신약개발연구조합에 따르면 올해 국내에서 혁신성을 인정받아 허가를 받은 신약은 1개다. 지난해 5개와 비교하면 저조한 실적이다. 보건복지부와 식품의약품안전처는 국내에서 처음으로 개발된 국산 신약 중 임상적 유효성이 있고 안전성이 있다고 결론이 나면 신약 허가를 내준다. 현재 국내 신약은 27개가 있다.
지난 1월1일 이후 이날까지 올해 신약 허가를 받은 제품은 단 1개. 한미약품의 올리타정(올무티닙 성분) 뿐이다. 이마저도 안전성 논란에서 자유로울 수가 없는 상황이다. 임상 2상 후 조건부로 허가가 난 신약이기 때문에 수천명을 대상으로 하는 임상 3상이란 벽을 넘어야 한다. 가뭄에 콩나듯이 난 올해 성과도 불안하다는 얘기다.
반면 지난해에는 22번째 신약부터 26번째까지 총 5개 신약이 나왔다. 크리스탈지노믹스가 '아셀렉스캡슐'로 신약 문을 열었고 동아에스티가 '슈가논정'으로 닫았다. 특히 동아에스티는 지난해 신약 허가를 3번이나 받았다.
 |
신약 개발이 장벽에 부딪힌 상황이지만 제약사들은 심각한 수준은 아니라는 분위기다. 지난해 성과가 유독 많아 올해 안 좋게 보인다는 설명이다. 임상 3상까지 마친 신약만 없을 뿐 중국 제약사에 신약후보물질을 수출한 유한양행 등 제약사가 계속 성과를 내고 있다는 입장이다.
한 제약사 관계자는 "신약 물질 개발, 전임상, 임상 1~3상 단계가 있고 각 단계를 통과할 때마다 성과를 인정해줘야 한다"며 "최종 허가가 난 신약이 없다고 성과 자체가 없다고 면 안 된다"고 말했다.
또 다른 제약사 관계자는 "국내에서 임상 2~3상 단계가 수백건"이라며 "신약 허가 소식이 계속 이어질 것"이라고 했다.
올 들어 식품의약품안전처는 463건의 임상을 승인했다. 이 중 3상은 123건, 2상은 86건이다. 제네릭(복제약) 임상 승인을 제외해도 수십개가 넘는 신약이 임상 3상 단계다.
한편 제약업계에 따르면 국내 주요 제약·바이오사 20개가 보유한 신약 파이프라인은 87개다. 이중 임상 3상은 15개다.
[뉴스핌 Newspim] 한태희 기자 (ace@newspim.com)























