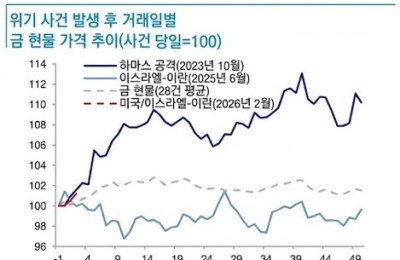
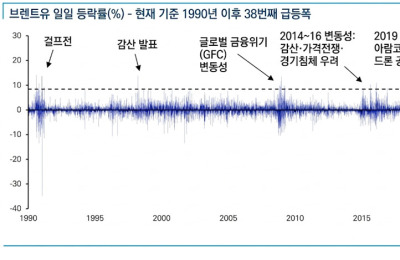
[서울=뉴스핌] 김신영 기자 = HLB사이언스는 18일(현지시간) 패혈증 및 그람음성 슈퍼박테리아 감염증 치료제로 개발 중인 'DD-S052P'의 1b/2a상 임상시험계획(IND)을 미국 식품의약국(FDA)에 제출했다고 밝혔다.
이번 임상은 2단계로 진행된다. 먼저 1b상에서는 건강한 지원자를 대상으로 DD-S052P와 기존 항생제인 콜리스틴을 병용 투약했을 때의 안전성, 내약성, 약동학(PK), 면역원성을 확인한다.

이어지는 2a상에서는 카바페넴 내성 아시네토박터 바우마니균(CRAB) 폐렴 환자를 대상으로 동일한 지표들을 평가하는 동시에 예비 효력 확인을 위한 탐색적 지표도 검토할 예정이다.
HLB사이언스는 지난 10월 DD-S052P의 임상 1상 최종보고서를 통해 단일투여의 안전성을 확인한 바 있다. 이러한 긍정적 데이터를 기반으로, 실제 환자 치료에서 치료 효과를 더욱 극대화하기 위해 후속 임상은 병용요법 중심으로 설계해 개발 전략을 한층 강화했다.
패혈증은 전 세계적으로 매년 약 5,000만 명이 발병하고 이 중 1100만 명이 사망하는 치명적 질환이지만, 항생제를 제외하면 승인된 치료제가 거의 없어 치사율이 30~50%에 이를 정도로 미충족 수요가 큰 분야다. 글로벌 패혈증 치료제 시장은 2023년 약 7억 4000만 달러 규모에서 2032년 15억 달러까지 성장할 것으로 전망되며, 연평균 9% 이상 증가가 예상되는 고성장 시장으로 꼽힌다.
윤종선 HLB사이언스 대표는 "이번 IND 제출은 당사가 추진해 온 패혈증 신약 개발이 글로벌 무대에서 본격적인 검증 단계로 접어들었음을 의미한다"며 "임상 진행과 더불어 해외 제약사들과의 공동개발 및 라이선싱 아웃 논의도 한층 탄력을 받을 것으로 기대한다"고 말했다.
한편 HLB사이언스는 지난 13일 임시주주총회에서 HLB와의 합병이 승인됨에 따라 다음달 31일자로 HLB에 흡수합병될 예정이다. 합병 이후 DD-S052P 개발은 HLB그룹의 통합 R&D 체계 아래에서 보다 효율적으로 추진될 계획이다.
sykim@newspim.com