삼성바이오 2호 미국 진출 의약품 탄생
美 판매 오는 6월 이후 예상
[서울=뉴스핌] 김근희 기자 = 삼성바이오에피스의 유방암 치료 바이오시밀러(바이오의약품 복제약) '온트루잔트'(프로젝트명 SB3)가 미국 판매 허가를 획득했다.

미국 식품의약국(FDA)은 18일(현지시간) 삼성바이오에피스의 온트루잔트 판매허가를 승인했다고 발표했다.
온트루잔트는 다국적 제약사 로슈의 초기 및 전이성 유방암, 전이성 위암 치료제 허셉틴(성분명 트라스트주맙)의 바이오시밀러다. 허셉틴은 2017년 약 7조8000억원의 매출을 기록한 전 세계 판매 8위 바이오 의약품이다. 같은 기간 미국에서는 2조8000억원의 매출을 올렸다.
앞서 온트루잔트는 한국에서는 '삼페넷', 유럽에서는 미국 판매명과 같은 온트루잔트라는 이름으로 2017년 11월 각각 허가를 받았다.
삼성바이오에피스는 2017년 12월 FDA에 온트루잔트의 판매허가를 신청했다. 업계에서는 통상 심사 기간이 10~12개월이라는 점을 고려해 판매 승인이 지난해 연말에 나올 것으로 예상했다. 그러나 지난해 11월 FDA가 삼성바이오에피스에 허가신청 기간을 연장한다고 통보했고, 이달 허가가 났다.
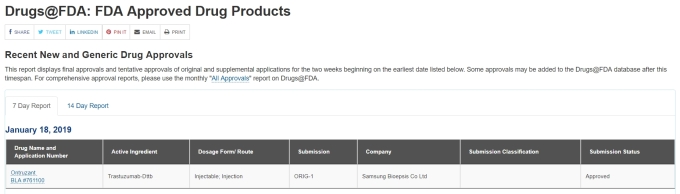
온트루잔트의 미국 내 판매는 삼성바이오에피스의 파트너사인 MSD(미국 머크)가 맡는다. 온트루잔트의 판매 시점은 허셉틴의 미국 물질 특허가 만료되는 오는 6월 이후가 될 것으로 보인다.
업계에서는 이번 판매허가가 삼성바이오에피스 바이오시밀러의 두 번째 미국 진출이라는 점에서 의미가 크다고 보고 있다. 회사는 앞서 2017년 4월 자가면역질환 치료 바이오시밀러 '렌플렉시스'의 미국 허가를 받은 바 있다.
업계 관계자는 "삼성바이오에피스가 렌플렉시스에 이어 온트루잔트 미국 허가 획득에 성공하면서 기술력을 입증했다"며 "렌플렉시스 판매 경험 등을 토대로 미국 시장을 공략할 것"이라고 말했다.
keun@newspim.com