[서울=뉴스핌] 배요한 기자 = 젠큐릭스는 국내 식품의약품안전처(식약처)로부터 갑상선암 돌연변이 검사인 '드롭플렉스 비라프 뮤테이션 테스트(Droplex BRAF Mutation Test)'에 대한 제조허가를 승인받았다고 8일 밝혔다.
드롭플렉스 비라프 뮤테이션 테스트는 갑상선암 환자에게서 흔하게 발생하는 BRAF 유전자 Codon600(V600E)의 돌연변이 유무를 디지털 PCR 방식으로 검사하는 제품이다. 유방암 예후진단 키트 진스웰BCT(GenesWell BCT), 폐암 동반진단키트인 진스웰 디디이지에프알 뮤테이션 테스트(GenesWell ddEGFR Mutation Test)에 이어 젠큐릭스가 국내 제조허가를 받은 세번째 제품이다.
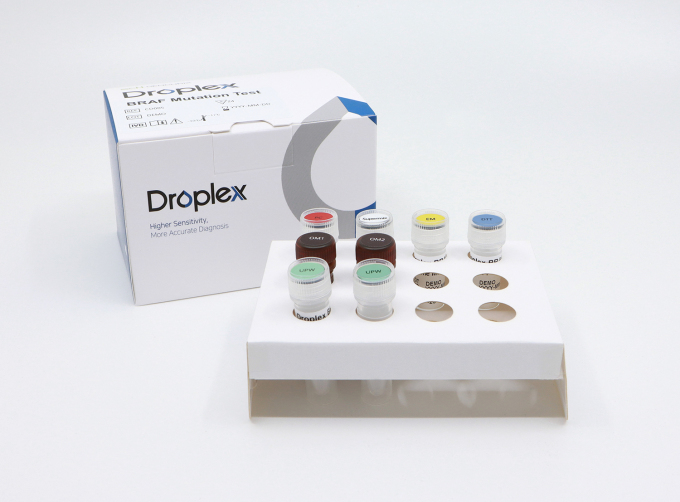
갑상선암은 국내에서 연간 3만명 이상의 신규 환자가 발생하는 발생률 1위 암종이다. 갑상선암 관련 가장 흔히 관찰되는 유전자 변이는 BRAF 돌연변이다. 그 중 BRAF V600E 돌연변이가 98% 이상을 차지한다. 또한 BRAF 돌연변이를 활용한 연구개발이나 치료제 승인은 흑색종(melanoma), 비소세포폐암(NSCLC), 직결장암 표적치료제 분야에서도 이뤄지고 있어 젠큐릭스의 드롭플렉스 BRAF 돌연변이 검사의 사용이 향후 더욱 확대될 것으로 기대하고 있다.
강미란 소장은 "드롭플렉스 검사는 기존 RT-PCR이 아닌 최신 디지털 PCR 기술을 적용해 50배 이상의 높은 민감도를 보이는 것이 특징"이라며 "폐암(Droplex EGFR Mutation Test v2), 대장암(Droplex KRAS Mutation Test) 및 자궁내막암(Droplex POLE Mutation Test) 동반진단 제품도 식약처 허가 심사가 진행 중으로 연내 추가 승인을 기대하고 있다"고 말했다.
한편 회사는 올해 상반기 갑상선암 돌연변이 검사를 포함해 폐암(Droplex EGFR Mutation Test v2), 대장암(Droplex KRAS Mutation Test) 등 총 8종의 동반진단 검사의 유럽 CE 등록을 마쳤다. 글로벌 진단장비업체 바이오래드(Bio-rad)와의 글로벌 영업/마케팅 협력을 통해 드롭플렉스(Droplex) 해외시장 진출에도 박차를 가하고 있다.
yohan@newspim.com