바이오협회 "기존보다 성능 좋은 제품이 승인에 유리"
[서울=뉴스핌] 김유림 기자 = 코로나19 확진자가 전 세계적으로 늘어나고 있는 가운데 국내 진단시약 개발 업체에 해외 주요 보건당국의 문의가 쏟아지고 있다. 총 4곳이 식품의약품안전처로부터 긴급사용 승인을 받았으며, 특히 이 중 유일하게 솔젠트가 원재료부터 시약까지 원스톱 생산 체계를 갖추고 있어 관심이 집중된다.
6일 질병관리본부에 따르면 솔젠트, SD바이오센서, 코젠바이오텍, 씨젠 등 4개 기업이 개발한 코로나19 유전자검사시약이 보건당국의 긴급사용 제품으로 활용되고 있다. .
앞서 질병관리본부는 '감염병 체외진단검사제품 긴급사용제도'를 시행했다. 감염병에 의한 국가 위기 또는 잠재적 위기 발생 위험이 있을 때 허가되지 않은 제품을 사용할 수 있게 하거나, 기존에 승인한 제품을 적용 가능한 질병 이외에도 사용할 수 있게 하는 것이다. 메르스와 지카 바이러스 사태 당시에도 진단키트 긴급사용제도를 시행한 바 있다.
이에 지난달 4일 코젠바이오텍, 12일 씨젠, 27일 솔젠트와 SD바이오센서의 제품을 검사시약으로 긴급사용 승인을 내렸다. 이들 외에도 개발을 마치고 정부에 긴급사용승인을 신청한 업체 30여 곳이 대기 중이다.
오기환 한국바이오협회 상무는 "이들 4개 기업 이외에도 많은 기업들이 긴급사용승인을 신청하고 결과를 기다리고 있다"며 "질병관리본부의 업무가 급증하고 있어 신청 검토절차가 다소 지연되는 것으로 알고 있다"고 말했다.
또한 "승인된 기업은 처음이라서 비교대상이 없었지만, 후 순위로 대기하고 있는 곳은 기존보다 성능이 더 좋지 않으면 탈락될 가능성도 있다는 점을 유의해야 한다"고 덧붙였다.
현재 전 세계적으로 한국의 코로나19 대응은 높이 평가받고 있으며, 진단능력이 이슈가 되고 있다. 스콧 고틀립 전 미국 식품의약국(FDA) 국장은 지난달 22일 자신의 트위터에 "한국은 거의 2만명이 진단 검사를 마쳤거나, 결과를 기다리고 있다"며 "한국은 상당한 진단 능력을 보여주고 있다"고 언급하기도 했다.
국내 긴급승인 업체 4곳 모두 이탈리아·독일·스페인·프랑스·영국·스위스 등 유럽국가뿐만 아니라 이스라엘·사우디아라비아·아랍에미리트연합(UAE) 등 30여개 국가로부터 수출 요청이 쏟아지고 있다. 정부 차원에서의 긴급요청까지 들어오고 있는 국가는 10여 곳에 달한다.
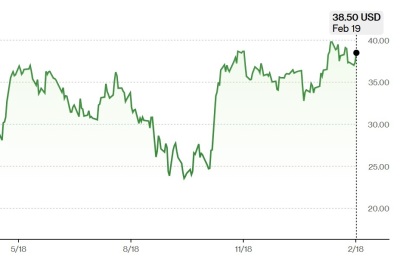
이 같은 소식이 전해지자 유일한 상장사 씨젠은 이날 가격 제한폭까지 치솟았다. 씨젠은 코스닥 시장에서 전 거래일 대비 29.97%(1만1150원) 오른 4만8350원을 기록했다.
씨젠 관계자는 "지금까지 국내 위주로 대응을 해왔는데, 확진자 수가 점차 줄어들 수 있어서 남은 물량을 해외로 수출할 여력이 있는 상황이다"며 "하루에 1만명분의 테스트가 가능한 분량까지 생산이 가능하다"고 말했다.
또 EDGC는 자회사 EDGC헬스케어를 통해 솔젠트의 지분 16.3%를 보유하고 있는 사실이 알려지면서 8.27%(470원) 상승한 6150원에 거래를 마쳤다.
특히 솔젠트는 승인받은 회사 중 유일하게 진단시약 핵심인 유전자 '증폭 효소'까지 직접 생산한다. 긴급승인을 받은 SD바이오센서·코젠바이오텍·씨젠 3곳은 글로벌 빅파마인 로슈 또는 솔젠트로부터 원료를 공급받아 진단시약을 만들어내고 있다.
솔젠트 관계자는 "전 세계 국가로부터 진단시약 긴급주문 요청 문의는 승인이 이뤄진 모든 회사에 쇄도하고 있을 것"이라며 "수출이 가장 빨리 이뤄질 것으로 예상되는 국가는 중국과 중동이다"고 전했다.
urim@newspim.com